فیزیک عمومی برای دانشجویان بهداشت
فیزیک عمومی برای دانشجویان بهداشت
فیزیک عمومی برای دانشجویان بهداشت (گرما و ترمودینامیک)
فرمت: PDF تعداد صفحات: 98
اتم ها، مولکول ها و فازهای ماده: اتم کوچک ترین واحد یک عنصر است. مولکول که ترکیبی از اتم هاست، کوچک ترین واحد یک جسم مرکب می باشد. برای نمونه، مولکول آب از دو اتم هیدروژن و اکسیژن تشکیل شده اند.
مولکول ها دائم در حال حرکت هستند. این حرکت همواره وجود دارد و نامنظم است، یعنی سرعت مولکول ها در گستره وسیعی توزیع شده است و متوسط آن به دمای جسم بستگی دارد. به عبارت دقیق تر، میانگین انرژی جنبشی مولکول ها به طور مستقیم به دما وابسته است. هرچه دما بیشتر باشد، سرعت میانگین هم بیشتر است.
ماده در فازهای گوناگونی وجود دارد که متداول ترین آنها جامد، مایع و گاز است.
- جامد: مولکول های جامد چنان به یکدیگر مقیدند که گویی با فنر به هم وصل شده اند.
- مایع: در مایع مولکول ها آزادی حرکت بیشتری دارند. مولکول های مایع مانند ساچمه های چسبناک داخل بلبرینگ رفتار می کنند و می توانند به راحتی روی هم بلغزند، ولی نمی توانند از همدیگر خیلی دور و یا به هم خیلی نزدیک شوند. مایع جریان می یابد و نمی تواند شکل خود را حفظ کند، مگر این که در ظرفی باشد.
- گاز: در گاز فاصله میان مولکول ها خیلی بیشتر از فاصله ی آنها در جامد و مایع است. به همین دلیل نیروی بین مولکول ها ضعیف اند، در نتیجه مولکول ها تقریبا مستقل از یکدیگر حرکت می کنند.
| الف) مولکول های جامد همواره همسایگان ثابتی دارند. |
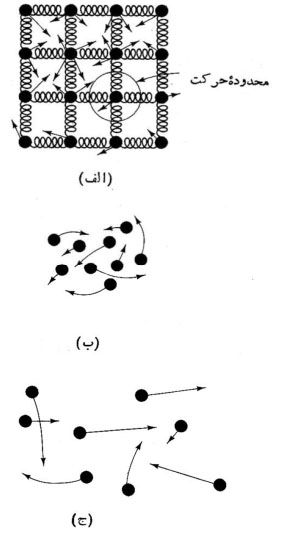 فازهای ماده |
| ب) مولکول های مایع می توانند به راحتی روی هم بلغزند ولی نمی توانند به همدیگر خیلی دور یا نزدیک شوند. | |
| ج) مولکول های گاز می توانند نسبتا آزادانه حرکت کنند. |
گاز ایده آل
- مقدار معینی از یک گاز، حجم یا چگالی معینی ندارد ولی اگر در ظرفی قرار بگیرد منبسط می شود و تمام فضای ظرف را پر می کند.
- رابطه معینی میان حجم، فشار و دمای یک گاز وجود دارد، طوری که مقدار معینی از یک گاز در هر فشار و دمای معین حجم مشخصی را اشغال می کند. این رابطه در مورد یک گاز چگال یا حقیقی بسیار پیچیده ولی برای یک گاز رقیق یا ایده آل بسیار ساده است.
- گاز ایده آل: یک گاز ایده آل گازی است که در آن مولکول ها به اندازه ای از هم دورند که به ندرت با هم برخورد می کنند.
- همه گازها در چگالی پایین ایده آل هستند.
- دانستن خواص یک گاز ایده آل اهمیت عملی دارد، چون گازهایی که در تنفس دخالت دارند تقریبا ایده آل هستند.
دما و گرما
واژه های دما و گرما معمولا با هم به کار می روند و ممکن است مترادف به نظر برسند. اگرچه دما و گرما بستگی نزدیکی به هم دارند، ولی مسلما یکی نیستند.
دما خاصیتی از جسم است که به میانگین انرژی جنبشی اتم ها و مولکول های آن جسم وابسته است، اما گرما شکلی از انرژی است، نه خاصیتی از جسم. در واقع تغییر دما موجب انتقال گرما می شود.
وقتی به جسمی گرما داده می شود، یکی از اثرهای آن افزایش دمای جسم است. برخی آثار دیگر گرما عبارتند از ذوب کردن جامدها و جوشاندن مایع ها. دمای یک جسم عددی است که صرفا مشخص می کند یک جسم از جسم دیگر گرم تر است یا سردتر.
مقیاس های دما
متداول ترین مقیاس دما در ایالات متحده، درجه فارنهایت (F°) است. در سطح جهان، مقیاس سلسیوس (C°) که سانتیگراد هم نامیده می شود، رایج ترین مقیاس است.
مقیاس دیگری که در کارهای علمی و فنی اهمیت بیشتری دارد، مقیاس کلوین (K) می باشد. اختلاف اصلی میان مقیاس های دما عبارتست از اندازه یکای اصلی (درجه) و دمایی که به عنوان صفر در نظر گرفته می شود.
یک راه برای تعریف مقياس دما عبارتست از انتخاب دو دما که به راحتی بتوان آنها را باز تولید کرد و نسبت دادن دو مقدار دلخواه به آنها مقیاس های فارنهایت و سلسیوس هر دو بر اساس نقاط انجماد و جوش آب پایه گذاری شده اند. این دو رویداد در صورتی که فشار مشخص شده باشد (که معمولا فشار استاندار جو در نظر گرفته می شود) در دماهای منحصر به فردی به وقوع می پیوندند.
در مقیاس فارنهایت دمای 32°F نقطه انجماد و F° 212 نقطه جوش آب است. در مقیاس سلسیوس نقطه انجماد آب C° 0 و نقطه جوش آب C° 100 است.
گرما: علت تغییر دما
گرما انرژی است که در اثر اختلاف دمای میان دو جسم از یکی به دیگری جریان می یابد. انرژی جنبشی مولکول های جسمی با دمای T1، به طور متوسط از انرژی جنبشی مولکول های جسمی با دمای پایین تر T2 بیشتر است. اگر این دو جسم با هم تماس پیدا کنند، مولکول های آنها در محل تماس با یکدیگر برخورد می کنند. در هر برخورد، مولکول های جسم گرم که انرژی زیادی دارند، انرژی از دست می دهند در حالی که مولکول های کم انرژی جسم سرد انرژی دریافت می کنند. در اثر این برخوردها انرژی به جسم سرد منتقل می شود.
انرژی ممکن است بدون آن که دو جسم با هم تماس پیدا کنند در اثر تابش از جسم گرم به جسم سرد منتقل شود. در واقع هنگامی که گرما به یک جسم وارد می شود به شکل دیگری از انرژی تبدیل می گردد، هم چنان که وقتی نور جذب می شود دیگر نور نیست، بلکه نوع دیگری از انرژی است.
گرما و گرمای ویژه
یک اثر مشهود گرما در یک جسم، افزایش دمای آن است که در این مورد گرما به انرژی گرمایی (انرژی درونی جسم) تبدیل می شود. انتقال گرما ممکن است موجب تغییر فاز شود. مانند ذوب شدن، جوشیدن، انجماد و چگالیدن، در همه موارد گرما به محض انتقال یافتن به صورت گرما باقی نمی ماند، بلکه به شکل دیگری از انرژی تبدیل می شود. مقدار گرمای لازم برای تولید اختلاف دما، به جرم جسم، اندازه تغییر دما (ΔT) و ماده ای که جسم از آن ساخته شده وابسته است. این مطلب با رابطه زیر بیان می شود:
Q = mcΔT
که Q مقدار انرژی گرمایی، m جرم جسم و گرمای ویژه ماده است.
گرمای ویژه: مقدار گرمای لازم برای اینکه دمای واحد جرم را به اندازه یک درجه افزایش دهد، گرمای ویژه آن جسم نامیده شده و با s یا c نمایش داده می شود.
گرمای ویژه خاصیت مشخصه یک ماده است. گرمای ویژه به دما بستگی دارد ولی در گستره دمایی محدودی می توان آن را ثابت در نظر گرفت. یکای گرمای ویژه عبارتست از کالری بر گرم بر درجه سلسیوس؛ Cal/g°C یا KCal/Kg °C.
گرمای ویژه آب در دمای C° 15 برابر Cal/g °C 1 است، زیرا مقدار گرمای لازم برای این که دمای یک گرم آب C° 15 را به اندازه یک درجه سلسیوس افزایش دهد به عنوان کالری تعریف شده است.
ادامه مطلب را با دانلود فایل پیوستی مشاهده کنید.
ورود یا ثبـــت نــــام + فعال کردن اکانت VIP
مزایای اشتراک ویژه : دسترسی به آرشیو هزاران مقالات تخصصی، درخواست مقالات فارسی و انگلیسی، مشاوره رایگان، تخفیف ویژه محصولات سایت و ...
حتما بخوانید:
⇐ کلیات نقشه برداری برای دانشجویان بهداشت



دیدگاه خود را ثبت کنید
تمایل دارید در گفتگوها شرکت کنید؟در گفتگو ها شرکت کنید.